EM/SFC et Covid long : comment une atteinte de l’endothélium pourrait relier les symptômes
Cet article scientifique, publié en 2026 dans Cell Death & Disease, est une revue mécanistique co-signée notamment par Etheresia Pretorius et Rob C. I. Wüst, deux chercheurs reconnus pour leurs travaux sur l’endothélium, la microcirculation, l’effort et les maladies post-infectieuses.
Il ne s’agit pas d’une étude expérimentale, mais d’un travail de mise en cohérence de la littérature existante. Les auteurs rassemblent des résultats issus de domaines variés afin de proposer un cadre explicatif intégratif pour l’EM/SFC et le Covid long. Les points ci-dessous résument pas à pas cette hypothèse, ses implications biologiques et sa portée.
🩵 L’essentiel
🔹 Les auteurs partent du constat que, dans l’EM/SFC et le Covid long, de nombreuses anomalies biologiques sont décrites, mais restent étudiées séparément (dysautonomie, troubles de la perfusion, anomalies musculaires, activation immunitaire).
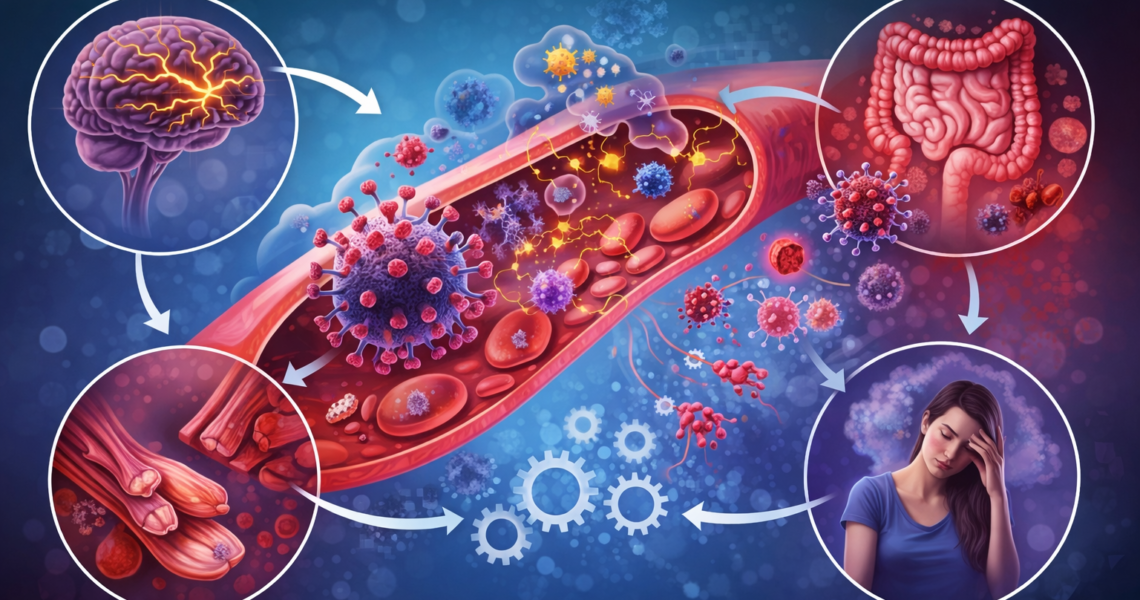
🔹 Ils proposent que l’endothélium, qui régule la circulation sanguine et l’échange entre le sang et les tissus, puisse constituer un point central commun reliant ces anomalies.
🔹 Une atteinte persistante de l’endothélium après une infection pourrait entraîner une altération durable de la microcirculation, en particulier lors de l’effort.
🔹 Cette dysfonction pourrait limiter l’apport en oxygène et en nutriments aux tissus, notamment aux muscles et au cerveau, malgré des examens classiques parfois normaux.
🔹 Les auteurs suggèrent que cette mauvaise adaptation vasculaire à l’effort pourrait contribuer à l’intolérance à l’effort et au malaise post-effort (MPE).
🔹 L’article met en lien cette hypothèse avec des observations déjà rapportées : anomalies de la coagulation, dysfonction endothéliale, troubles du tonus vasculaire et réponses anormales à l’effort.
🔹 Ce modèle permettrait de comprendre comment des symptômes multiples et fluctuants peuvent émerger d’un dysfonctionnement central commun, sans supposer une atteinte unique d’organe.
🔹 Les auteurs soulignent que cette proposition doit maintenant être testée expérimentalement, notamment par des études ciblant la fonction endothéliale et la microcirculation à l’effort.
1. Nature de cet article
Dans un article publié en 2026 dans Cell Death & Disease, plusieurs chercheurs proposent une hypothèse mécanistique pour l’EM/SFC et le Covid long. Il ne s’agit pas d’une étude expérimentale : aucun patient n’a été recruté et aucun test clinique ou biologique n’a été réalisé spécifiquement pour cet article.
Les auteurs ont rassemblé et mis en cohérence un grand nombre d’études déjà publiées, issues de domaines différents, afin de proposer un modèle explicatif global. L’objectif n’est pas de prouver, mais de structurer et orienter la compréhension et la recherche.
2. Le constat de départ
Les auteurs partent du constat que l’EM/SFC et le Covid long sont deux maladies post-virales partageant de nombreux symptômes, mais qu’aucun mécanisme central reconnu ne permet encore d’expliquer leur déclenchement, leur diversité clinique et leur chronicité.
De nombreuses hypothèses existent déjà, mais elles sont souvent étudiées séparément. Cette fragmentation rend difficile une vision d’ensemble capable de relier les symptômes, les anomalies biologiques et leur persistance dans le temps.
3. Une approche intégrative
L’objectif de cette revue est de relier plusieurs mécanismes biologiques déjà décrits autour d’un même axe central, plutôt que d’en proposer un nouveau isolé. Les auteurs cherchent une cohérence physiologique entre des observations jusque-là dispersées.
Ils proposent que certaines atteintes observées dans l’EM/SFC et le Covid long puissent être comprises comme différentes conséquences d’un même processus biologique sous-jacent.
4. Le rôle de l’endothélium
L’endothélium est la couche de cellules qui tapisse l’intérieur des vaisseaux sanguins. Il joue un rôle essentiel dans la régulation du flux sanguin, de la perfusion des tissus, de l’oxygénation, de la coagulation et de l’inflammation.
Une altération de l’endothélium peut donc avoir des effets systémiques, affectant simultanément le cerveau, les muscles, le système digestif et la régulation autonome.
5. Données déjà connues
De nombreuses études ont déjà mis en évidence une dysfonction endothéliale dans l’EM/SFC et le Covid long, notamment des anomalies de la microcirculation et une hypoperfusion cérébrale.
Ces anomalies sont observées aussi bien au repos qu’à l’effort et sont compatibles avec des symptômes comme la fatigue profonde, les troubles cognitifs et l’intolérance orthostatique.
6. L’apport central de l’article
L’élément central apporté par cette revue est l’hypothèse que l’endothélium ne serait pas seulement dysfonctionnel, mais partiellement entré dans un état appelé sénescence.
La sénescence est un état dans lequel une cellule cesse de fonctionner normalement sans mourir, tout en modifiant durablement son environnement par des signaux inflammatoires et délétères.
7. Infection virale et sénescence
Les auteurs suggèrent que certaines infections virales aiguës peuvent induire une sénescence des cellules endothéliales, soit par infection directe, soit via l’inflammation et le stress oxydatif.
Plusieurs virus impliqués dans l’EM/SFC et le Covid long sont capables d’affecter l’endothélium, ce qui rend cette hypothèse biologiquement plausible.
8. Une sénescence persistante
En temps normal, les cellules sénescentes sont éliminées par le système immunitaire. Or, des anomalies immunitaires sont fréquemment décrites dans l’EM/SFC et le Covid long.
Les auteurs proposent que ces dysfonctionnements empêchent une élimination efficace des cellules endothéliales sénescentes, permettant leur persistance sur le long terme.
9. Le SASP endothélial
Les cellules endothéliales sénescentes adoptent un profil appelé SASP, caractérisé par la libération de molécules pro-inflammatoires, pro-coagulantes et vaso-constrictives.
Ce profil favorise une inflammation chronique, une altération de la circulation sanguine et une mauvaise adaptation des vaisseaux aux besoins des tissus.
10. Altération de la perfusion
La sénescence endothéliale est associée à une diminution des mécanismes de vasodilatation et à une augmentation de signaux favorisant la vasoconstriction.
Ce déséquilibre peut contribuer aux troubles de perfusion observés dans l’EM/SFC et le Covid long, en particulier au niveau cérébral.
11. Hypoperfusion cérébrale
Une perfusion cérébrale insuffisante peut entraîner des troubles cognitifs, une fatigue mentale marquée et une intolérance aux stimulations.
Plusieurs études ont déjà montré une réduction du flux sanguin cérébral dans l’EM/SFC, même en l’absence d’anomalies classiques de la pression artérielle.
12. Lien avec la dysautonomie
L’endothélium interagit étroitement avec le système nerveux autonome pour réguler le tonus vasculaire.
Une atteinte endothéliale chronique pourrait contribuer aux symptômes de dysautonomie, tels que l’intolérance orthostatique, les palpitations ou les variations anormales de la fréquence cardiaque.
13. Les muscles et l’effort
Lors d’un effort, les muscles nécessitent une augmentation rapide et adaptée de l’apport en oxygène et en nutriments.
Un endothélium sénescent répond moins efficacement à ces demandes, ce qui peut entraîner une mauvaise extraction de l’oxygène et une accumulation de déchets métaboliques.
14. Le malaise post-effort
Ce mécanisme pourrait contribuer à expliquer le Malaise Post-Effort, symptôme central de l’EM/SFC, caractérisé par une aggravation retardée et prolongée des symptômes après un effort.
L’incapacité de l’endothélium à s’adapter correctement à l’effort pourrait déclencher une cascade inflammatoire et métabolique disproportionnée.
15. Atteinte digestive
Les auteurs évoquent également une possible sénescence endothéliale au niveau intestinal, pouvant altérer la barrière digestive.
Cela pourrait favoriser une perméabilité intestinale accrue et une activation immunitaire chronique, déjà décrites dans l’EM/SFC et le Covid long.
16. Coagulation et micro-anomalies
La sénescence endothéliale favorise un état pro-coagulant, avec une activation plaquettaire et une diminution des mécanismes de fibrinolyse.
Ce contexte est compatible avec certaines anomalies de la coagulation et la présence de micro-caillots décrites dans plusieurs études.
17. Un cercle auto-entretenu
Selon cette hypothèse, la sénescence endothéliale et la dysfonction immunitaire s’auto-entretiennent : l’endothélium sénescent aggrave les anomalies immunitaires, qui empêchent à leur tour son élimination.
Ce cercle vicieux pourrait expliquer la chronicité et la stabilité des symptômes sur plusieurs années.
18. Portée de cette hypothèse
Cette revue ne prétend pas démontrer définitivement un mécanisme unique, mais propose un cadre cohérent reliant de nombreuses observations existantes.
Elle vise à orienter la recherche future, en suggérant des pistes biologiques à explorer plutôt qu’en apportant des preuves expérimentales définitives.
Source
Nunes, M., Kell, L., Slaghekke, A., Wüst, R. C., Fielding, B. C., Kell, D. B., & Pretorius, E. (2026). Virus-induced endothelial senescence as a cause and driving factor for ME/CFS and long COVID : mediated by a dysfunctional immune system. Cell Death And Disease, 17(1). https://doi.org/10.1038/s41419-025-08162-2
Bonjour.
Merci beaucoup pour votre démarche, vos observations et vos hypothèses, nécessaires pour aboutir à une synthèse des recherches effectuées jusqu’ici.
Atteint d’EM après une grippe en 2008, je continue d’espérer qu’un traitement voit le jour…
Cordialement,
S. Oberg
Bonjour,
Merci sincèrement pour votre message et pour votre témoignage.
Votre parcours fait écho à celui de nombreuses personnes et rappelle l’importance de continuer à documenter et partager les connaissances disponibles.
J’espère également que la recherche permettra, dans les années à venir, de véritables avancées thérapeutiques.
Merci pour votre soutien et prenez soin de vous.