Syndromes post-infectieux : une perspective historique et scientifique
Par ClémenceSyndromes post-infectieux : histoire, mécanismes et implications modernes
Cet article, publié dans Trends in Immunology, propose une mise en perspective historique et scientifique des syndromes post-infectieux (PAIS). Même si l’attention actuelle porte surtout sur le COVID long, les autrices rappellent que ce phénomène accompagne les épidémies depuis plus d’un siècle. L’intérêt majeur du texte est de fournir une lecture structurée, transversale, reliant les observations passées aux données immunologiques modernes.
Ci-dessous, un résumé fidèle et enrichi des points essentiels.
🩵 L’essentiel
🔹 Les syndromes post-infectieux existent depuis plus de cent ans, mais restent encore mal compris malgré de nombreuses descriptions cliniques.
🔹 Les chercheurs proposent plusieurs explications possibles : persistance de fragments viraux, dérèglement immunitaire, auto-anticorps, inflammation chronique ou co-infections.
🔹 Les profils observés dans le Long COVID, l’EM/SFC et d’autres PAIS montrent des similarités importantes, suggérant des mécanismes biologiques communs.
🔹 De nombreuses études mettent en évidence des anomalies du système immunitaire : cellules T et B altérées, auto-anticorps, troubles de la communication immunitaire.
🔹 Malgré les avancées, plusieurs questions fondamentales restent ouvertes : pourquoi certaines personnes développent un PAIS ? Quels mécanismes dominent selon les patients ? Comment mieux cibler les traitements ?
Contexte général : ce que l’on apprend de l’article
Depuis la pandémie de SARS-CoV-2, l’existence de séquelles durables après une infection aiguë est davantage reconnue. Pourtant, l’article montre que des tableaux similaires ont été décrits bien avant l’ère moderne de l’immunologie.
Les autrices insistent sur un point central : l’absence d’anomalies dans les bilans standards ne prouve pas l’absence de maladie. De nombreux biomarqueurs objectifs différencient pourtant Long COVID, EM/SFC et individus sains.
Une continuité historique des syndromes post-infectieux
Les archives médicales montrent une récurrence des syndromes post-infectieux après les grandes épidémies.
◆ Grippe russe (1889) : fatigue prolongée, douleurs, neuropathies.
◆ Grippe de 1918 : encéphalite léthargique, avec 15 935 cas répertoriés et 48 % de mortalité.
◆ Poliomyélite : plus de 21 000 paralysies en 1952 ; apparition du post-polio.
◆ SARS (2003) : fatigue, faiblesse, troubles cognitifs persistants.
◆ Ebola : inflammation prolongée, anomalies immunitaires durables.
◆ EBV : 4–10 % présentent une fatigue prolongée après mononucléose.
◆ Chikungunya : 25 % développent un rhumatisme inflammatoire chronique.
Ces similarités montrent que les PAIS ne sont pas nouveaux.
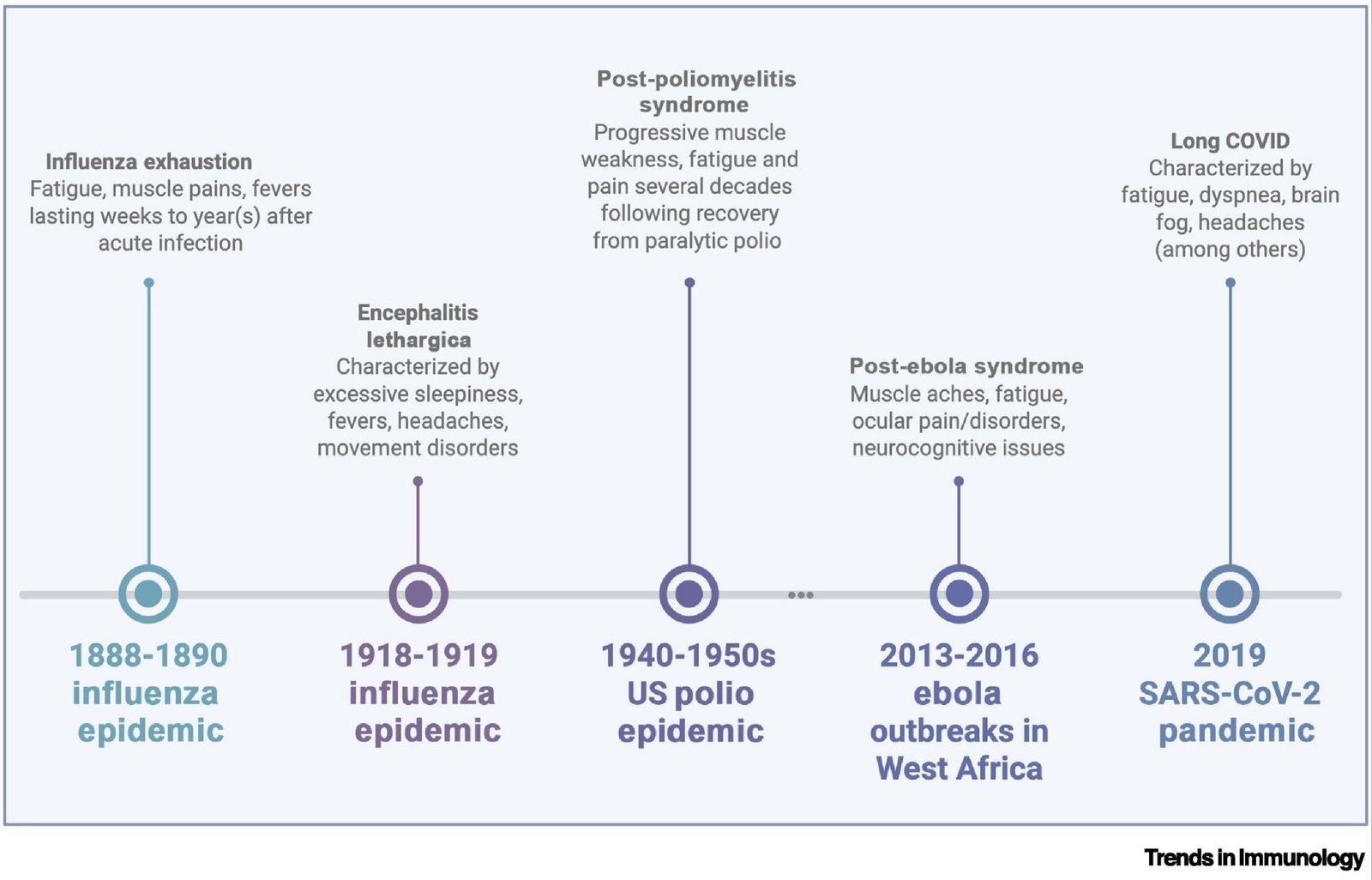
Cette figure présente plusieurs épidémies majeures (1889–2020) et les syndromes post-infectieux associés, incluant la fatigue post-grippale, l’encéphalite léthargique, le post-polio, le post-Ebola et le Long COVID. Elle illustre la récurrence historique de séquelles post-infectieuses malgré des agents pathogènes très différents.
Typologie des mécanismes possibles derrière les PAIS
L’article distingue plusieurs mécanismes physiopathologiques susceptibles d’expliquer l’apparition des PAIS.
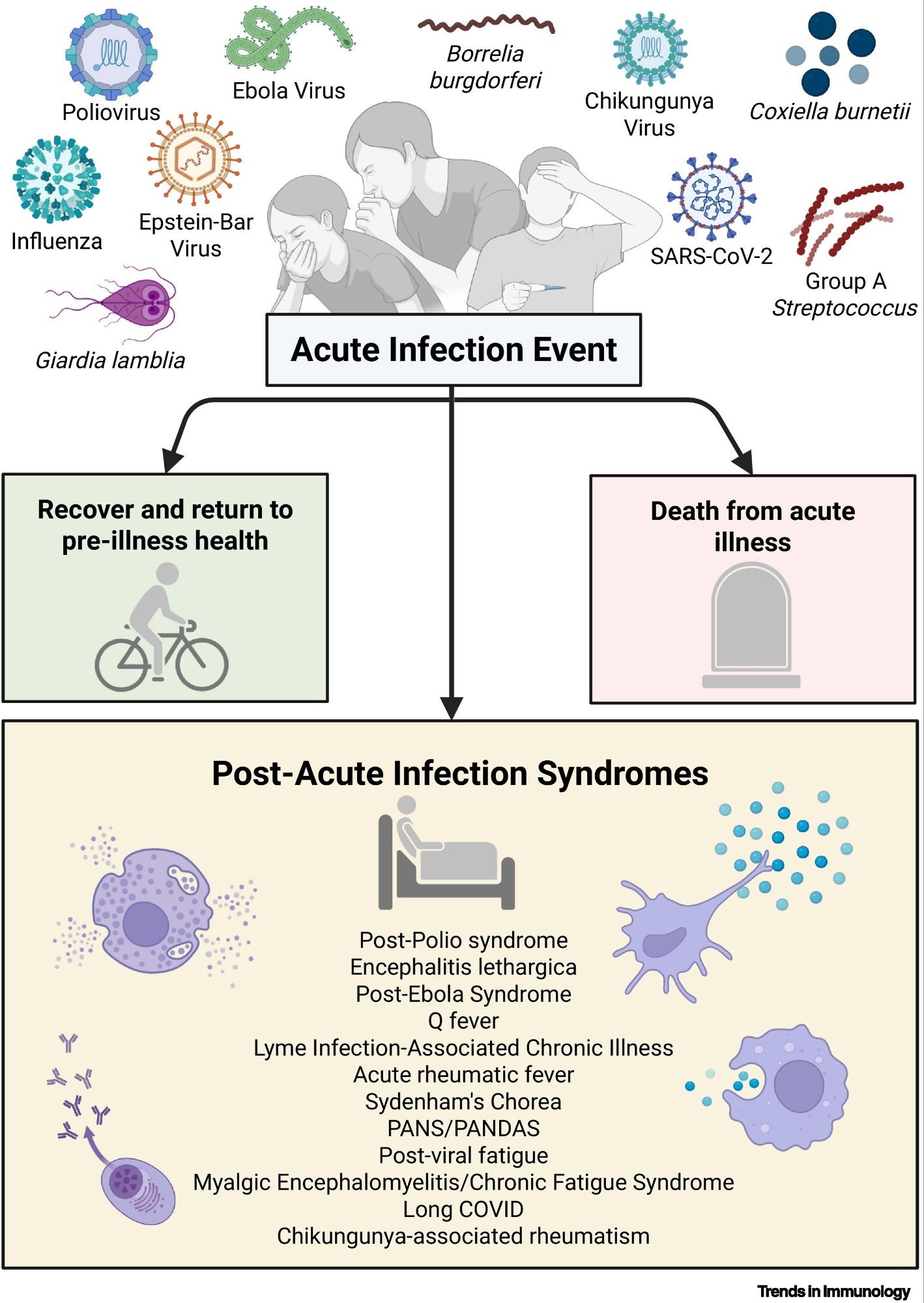
(Reproduite de Miller, Moen, & Iwasaki, 2025)
Cette figure résume le devenir possible d’un événement infectieux aigu : guérison, décès ou évolution vers un syndrome post-infectieux. Elle illustre la diversité des agents pathogènes impliqués (virus, bactéries, parasites) et liste les principaux PAIS décrits, dont le post-poliomyélite, l’encéphalite léthargique, le post-Ebola, les syndromes associés à Lyme, Q fever, les troubles neuropsychiatriques post-streptococciques (PANS/PANDAS), la fatigue post-virale, l’EM/SFC et le Long COVID.
◆Persistance virale ou antigénique : SARS-CoV-2, Ebola, Borrelia.
◆ Mimétisme moléculaire auto-immun : streptocoque A (RAA, Sydenham, PANDAS).
◆ Inflammation chronique : Q-Fever, certains cas post-EBV.
◆ Co-infections : Borrelia + Babesia / Rickettsia.
◆ Dérégulation immunitaire durable observée dans tous les PAIS.
Ces mécanismes permettent de comprendre pourquoi des infections différentes produisent des syndromes similaires.
Dysrégulation immunitaire : un mécanisme partagé
De nombreuses études montrent des perturbations immunitaires persistantes.
◆ Monocytes et neutrophiles anormaux.
◆ Cytokines élevées (dont CCL11).
◆ Épuisement des lymphocytes T, dysfonction des lymphocytes B.
◆ Auto-anticorps, y compris neuronaux.
◆ Persistance de fragments viraux jusqu’à 910 jours.
◆ Atteinte des petites fibres nerveuses.
Ces données appuient l’idée d’un dysfonctionnement biologique réel.
ME/SFC : un PAIS ancien, longtemps psychologisé
L’encéphalomyélite myalgique, décrite dès 1955, a ensuite été reclassée en “CFS”, ce qui a contribué à réduire son interprétation biologique.
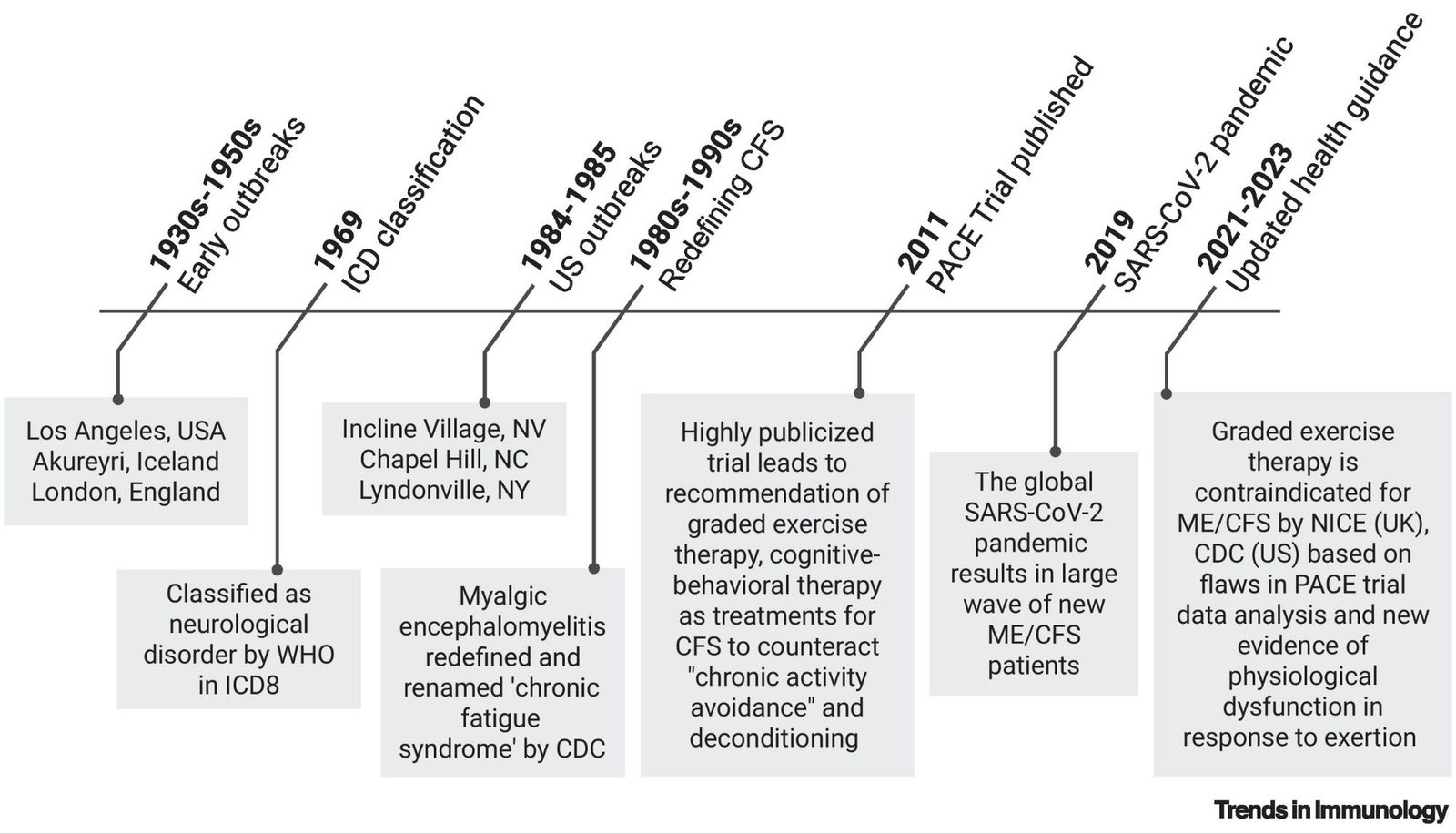
(Reproduite de Miller, Moen, & Iwasaki, 2025)
Cette figure retrace les principales étapes historiques liées à l’encéphalomyélite myalgique, depuis les premières épidémies (années 1930–1950) jusqu’aux recommandations officielles révisées entre 2021 et 2023. Elle illustre la classification initiale comme maladie neurologique, la redéfinition en “chronic fatigue syndrome”, l’impact du PACE Trial et la réévaluation des pratiques thérapeutiques par les autorités de santé.
Le texte met en avant plusieurs éléments :
◆ Anomalies immunitaires documentées depuis les années 1980.
◆ Symptôme cardinal : le MPE.
◆ Qualité de vie très altérée.
◆ Peu de financements biomédicaux.
◆ Modèle psychogène et GET désormais remis en cause.
Un point important porte sur la relation EBV – sclérose en plaques :
◆ B-cells clonales ciblant EBNA1 + mimétisme avec GlialCAM.
◆ Lymphocytes T spécifiques d’EBV retrouvés dans le LCR. Ces données renforcent l’idée d’un mécanisme auto-immun post-infectieux.
EM/SFC et COVID long : un chevauchement important
Les deux conditions présentent des similarités fortes :
◆ MPE,
◆ signatures inflammatoires comparables,
◆ anomalies T et B,
◆ atteinte des petites fibres nerveuses,
◆ dysfonction immunitaire adaptative.
Questions clés qui restent ouvertes
Les autrices soulignent plusieurs questions scientifiques majeures :
◆ Pourquoi des pathogènes très différents produisent-ils des séquelles similaires ?
◆ Pourquoi certains patients récupèrent-ils complètement alors que d’autres basculent dans un PAIS ?
◆ Quel est le rôle exact de la dysrégulation immunitaire (persistance, inflammation localisée, infection tissulaire) ?
◆ Comment comprendre les tableaux de type EM/SFC après des événements non infectieux ?
Conclusion
Les syndromes post-infectieux représentent un champ majeur de la médecine moderne. L’article montre qu’ils ne sont ni nouveaux ni rares, et que leur compréhension nécessite des approches intégrées, historiques et biologiques.
Source
Miller, C. M., Moen, J. K., & Iwasaki, A. (2025). The lingering shadow of epidemics: Post-acute sequelae across history. Trends in Immunology. Advance online publication. https://www.cell.com/trends/immunology/fulltext/S1471-4906(25)00267-4
Bonjour, diagnostiquée covid long en 2022, tepscan cérébral avec lésions côté droit et central du cerveau, hospitalisation de jour et ras, après moultes examens,imageries mon état ne s’améliore pas, je dirais même parfois pire, acouphènes, brouillard cérébral et fatigue épuisante.
Je n’en peux plus.
Bonjour,
Merci d’avoir pris le temps de témoigner ici. Ce que vous décrivez — la persistance des symptômes neurologiques, la fatigue profonde, le brouillard cognitif, les acouphènes — correspond malheureusement à ce que vivent de nombreuses personnes atteintes de Covid long, y compris après des examens nombreux et parfois lourds.
Le fait que l’état ne s’améliore pas, voire s’aggrave par moments, est aujourd’hui reconnu dans les syndromes post-infectieux, même si la prise en charge reste encore très insuffisante.
Votre message est légitime. Il rappelle pourquoi il est essentiel de continuer à informer, documenter et faire avancer la recherche sur ces maladies.
Je vous souhaite beaucoup de courage.